SCIENTICLIC, le site de la science et de la découverte(en construction)scienticlic@yahoo.fr Le prochain article portera sur les forces fondamentales |
 |
Bienvenue sur : scienticlic.wifeo.com  visites visites |
SCIENTICLIC, le site de la science et de la découverte(en construction)scienticlic@yahoo.fr Le prochain article portera sur les forces fondamentales |
 |
Bienvenue sur : scienticlic.wifeo.com  visites visites |
Pour déterminer la formule brute d'une molécule, on compte le nombre et le type d'atomes qui la composent. On écrit le symbole de l'atome puis on rajoute en indice le nombre de ce type d'atome présents dans la molécule.
Exemple : Propane
On a dans cette molécule 3 atomes de carbone et 8 atomes d'hydrogène. La formule brute est donc C3H8.
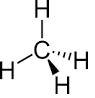
La formule semi-développée d'un molécule est une représentation symbolique de celle-ci. On y représente les atomes par leurs symboles ainsi que les liaisons atomiques. Les liaisons hydrigène ne sont pas représentées.
Exemple : Propane

CH3-CH2-CH3
A la différence de la formule semi-développée, la formule développée fait apparaître les liaisons hydrogène.
Exemple : Propane
 -->
--> 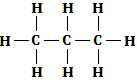
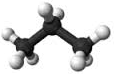
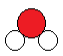
Pour le modèle moléculaire compact, on utilise des boules de couleur sans faire apparaître les liaisons.
Exemple: Eau (H2O)
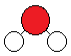
Pour le modèle moléculaire éclaté, on utilise aussi des boules de couleur en faisant apparaître les liaisons.
Exemple : Eau (H2O)
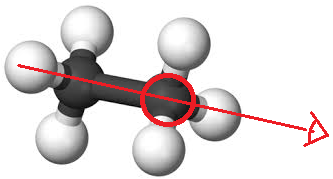
Cette représentation est la plus facile : on trace un simple trait pour représenter une liaison carbone-carbone. Il y a donc un carbone à chaque extrémité de la chaîne et à chaque « pic ». S'il y a d'autres atomes sur la chaîne que le carbone, on note leur symbole.
Exemple : Propane
 -->
--> 
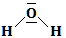
 -->
--> 
 -->
-->