SCIENTICLIC, le site de la science et de la découverte(en construction)scienticlic@yahoo.fr Le prochain article portera sur les forces fondamentales |
 |
Bienvenue sur : scienticlic.wifeo.com  visites visites |
SCIENTICLIC, le site de la science et de la découverte(en construction)scienticlic@yahoo.fr Le prochain article portera sur les forces fondamentales |
 |
Bienvenue sur : scienticlic.wifeo.com  visites visites |

Le tableau périodique des éléments est un tableau qui regroupe tous les éléments chimiques et les organise en fonction de leurs propriétés et de leur structure.
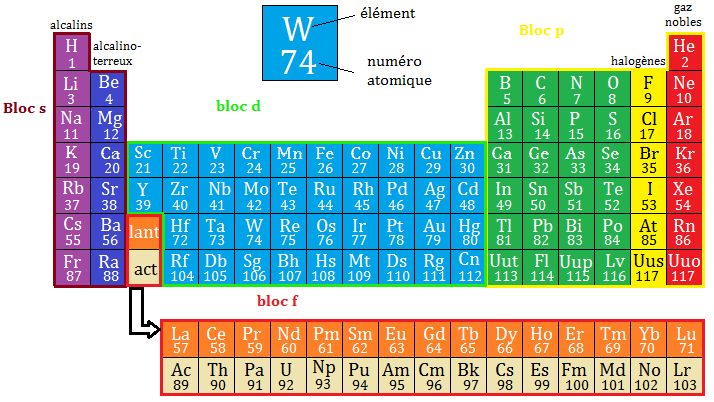
I. Construction
→ Les éléments sont classés par numéro atomique Z croissant (le numéro atomique Z est le nombre de protons dans un noyau atomique).
→ Le tableau est constitué de lignes, les périodes, et de colonnes, les familles. Il y a 7 lignes et 18 colonnes.
→ Les élément d'une même période ont le même nombre quantique n (couche électronique) et les éléments d'une même famille ont la même structure électronique externe (mêmes propriétés physiques et chimiques).
II. Principales familles du tableau
→ Colonne 1 : les alcalins. Ce sont des métaux (sauf l'hydrogène) qui n'ont qu'un seul électron de valence et qui ont donc tendance à le donner (règle de l'octet). Ils sont très réactifs
→ Colonne 2 : les alcalino-terreux. Ils ont deux électrons de valence et sont très réactifs.
→ Colonne 17 : les halogènes. Ils ont sept électrons de valence et ont tendance à attirer un électrons pour se stabiliser (règle de l'octet).
→ Colonne 18 : gaz rares (nobles). Ils ont huit électrons de valence et donc sont stables (couche électronique saturée) et réagissent peu.
III/ Blocs du tableau
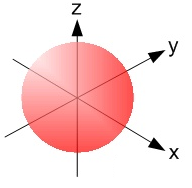
→ Bloc s (colonnes 1 et 2) : l'orbitale des atomes de ce bloc est de type s.
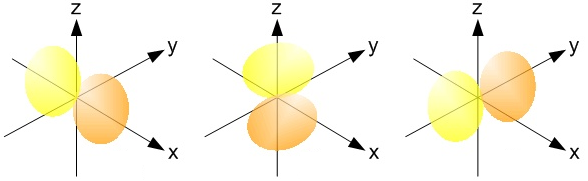
→ Bloc p (colonnes 13 à 18) : l'orbitale des atomes de ce bloc est de type p.
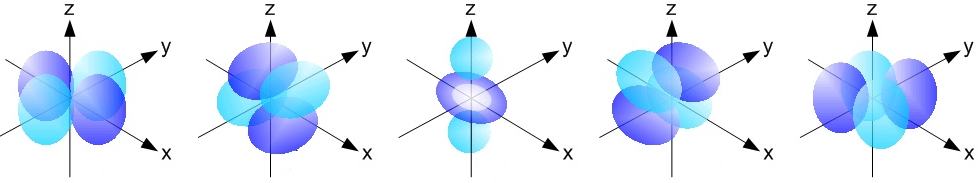
→ Bloc d (colonnes 3 à 12) : l'orbitale des atomes de ce bloc est de type d.
→ Bloc f (lanthanides et actinides) : l'orbitale des atomes de ce bloc est de type f.
IV/ Bref historique
→ Au début, l'homme pensait que la matière était faite de feu, d'eau, de terre et d'air. Mais au fil du temps, il a été démontré que la matière était faite d'atomes, des petits éléments. Il a fallu ordonner ces éléments pour mieux comprendre la matière. Ils ont été classés de différentes façons au fil des siècles jusqu'à obtenir le tableau que nous connaissons aujourd'hui.
→ Döbereiner: ce chimiste a classé certains groupes d'atomes par « triades » en comparant leurs masses atomiques (ex : chlore, brome et iode). La masse atomique de l'élément intermédiaire était la moyenne des deux autres.
→ Chancourtois : géologue français, il a mis en évidence la périodicité de certains éléments du tableau. Il établit en 1864 avec Newland, un chimiste anglais, la règle de l'octave : le huitième élément qui suit un élément donné ressemble au premier.
→ Meyer : il remarqua la périodicité dans le volume atomique. Les éléments semblables auraient un volume atomique semblable.
→ Mendeleïev : En 1869, il présenta la première version cohérente du tableau périodique. Il a classé les éléments par masse atomique ce qui a crée une périodicité concernant les propriétés de ces éléments. Il recensa 63 éléments. Les éléments sont classés par familles et par périodes. Il y a laisser des cases vides, étant sûr que les éléments manquants allaient être découverts, ce qui se passa.